Publikationen
Wissenschaftler von ISAR Bioscience publizieren ihre Ergebnisse regelmäßig in renommierten Fachjournalen.
Publikationen
Wissenschaftler von ISAR Bioscience publizieren ihre Ergebnisse regelmäßig in renommierten Fachjournalen.
Aktuelle Publikationen
Publikationen von ISAR Bioscience in PubMed
Alle Publikationen
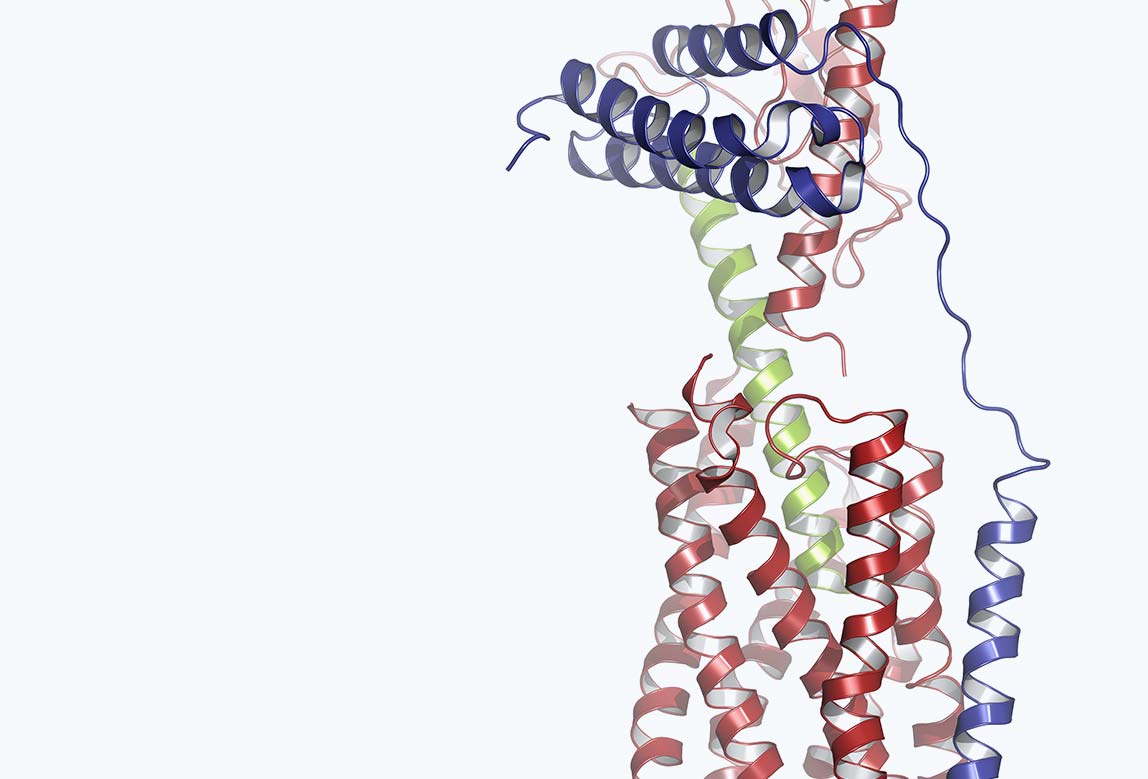
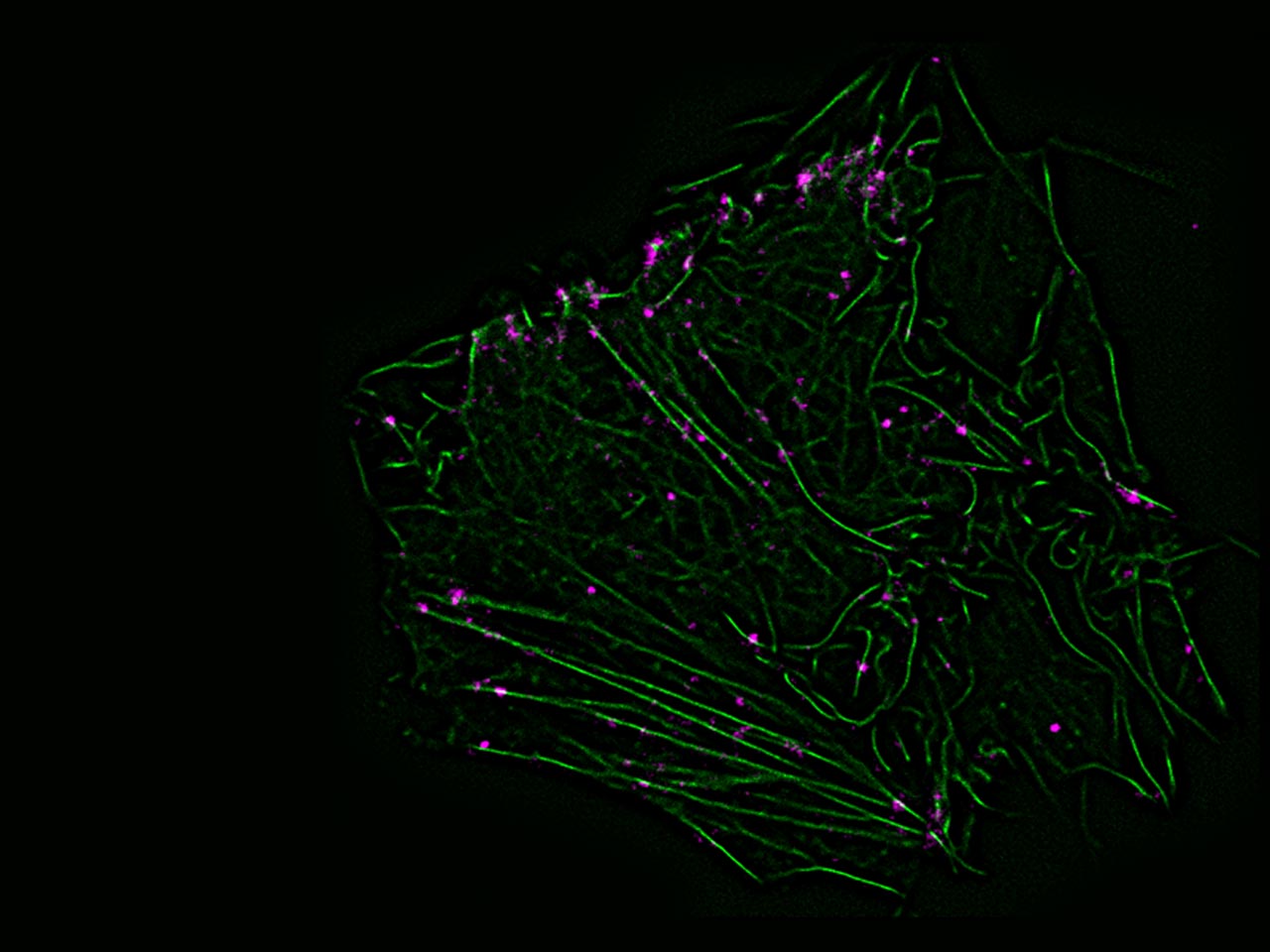
Işbilir A, Möller J, Arimont M, Bobkov V, Perpiñá-Viciano C, Hoffmann C, Inoue A, Heukers R, de Graaf C, Smit MJ, Annibale P, Lohse MJ (2020) Advanced fluorescence microscopy reveals disruption of dynamic CXCR4 dimerization by subpocket-specific inverse agonists. Proc Natl Acad Sci U S A 117: 29144-29154.
doi: 10.1073/pnas.2013319117.
Ein internationales Forscherteam um Martin Lohse von ISAR Bioscience hat mit modernsten Mikroskopiemethoden untersucht, wie ein bestimmter Chemokinrezeptor (CXCR4) sich auf der Zelloberfläche verhält. Diese Rezeptoren bilden konzentrationsabhängig Dimere. Auf Krebszellen, die sehr viele dieser Rezeptoren haben, überwiegt deshalb die Paarbildung. Bestimmte Substanzen, die die CXCR4-Rezeptoren blockieren, hemmen auch die Dimerisierung. Solche Substanzen könnten für die Krebstherapie von besonderem Interesse sein.
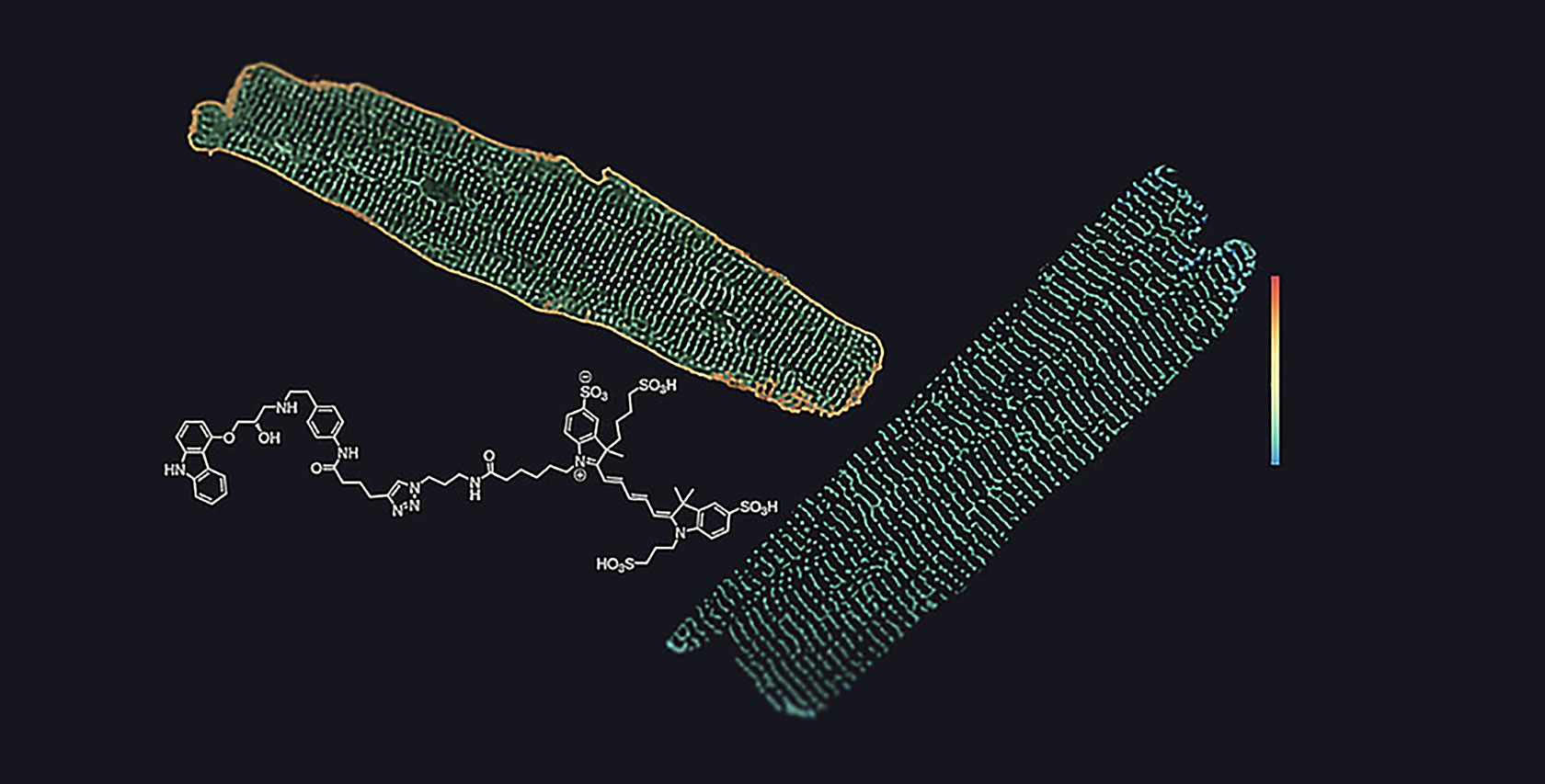
Bock A, Annibale P, Konrad C, Hannawacker A, Anton SE, Maiellaro I, Zabel U, Sivaramakrishnan S, Falcke M, Lohse MJ (2020) Optical Mapping of cAMP Signaling at the Nanometer Scale. Cell. 182: 1519-1530.e17.
doi: 10.1016/j.cell.2020.07.035.
Wie gelingt es einem Botenstoff, ganz unterschiedliche Reaktionen in einer Zelle auszulösen? Diese seit Jahrzehnten offene Forschungsfrage beantwortet diese Publikation für den Botenstoff cAMP. Das Team um Martin Lohse zeigt, dass cAMP in einer Zelle nicht einheitlich verteilt ist, sondern dass rund um die abbauenden Enzyme, Phosphodiesterasen, die Konzentrationen viel niedriger sind.
Möller J, Isbilir A, Sungkaworn T, Osberg B, Karathanasis C, Sunkara V, Grushevskyi EO, Bock A, Annibale P, Heilemann M, Schütte C, Lohse MJ (2020) Single-molecule analysis reveals agonist-specific dimer formation of µ-opioid receptors. Nature Chemical Biology 16: 946-954.
doi: 10.1038/s41589-020-0566-1.
µ-Opioidrezeptoren vermitteln die Effekte von Morphin und ähnlichen starken Schmerzmitteln. Sie sind sowohl für die erwünschte Schmerzstillung als auch für zahlreiche unerwünschte Wirkungen verantwortlich. Bisher ist es nicht gelungen, erwünschte von unerwünschten Effekten zu trennen. Einem Team um Martin Lohse von ISAR Bioscience ist es nun gelungen zu zeigen, dass sich morphinartige Substanzen in ihren Wirkungen auf µ-Opioidrezeptoren unterscheiden. Manche Substanzen fördern die Bildung von Rezeptor-Dimeren, während andere dies nicht tun. Das weckt die Hoffnung, dass es möglich ist, morphinartige Substanzen zu entwickeln, die weniger unerwünschte Wirkungen zeigen als das Morphin selbst.