Rezeptoren und zelluläre Kommunikation
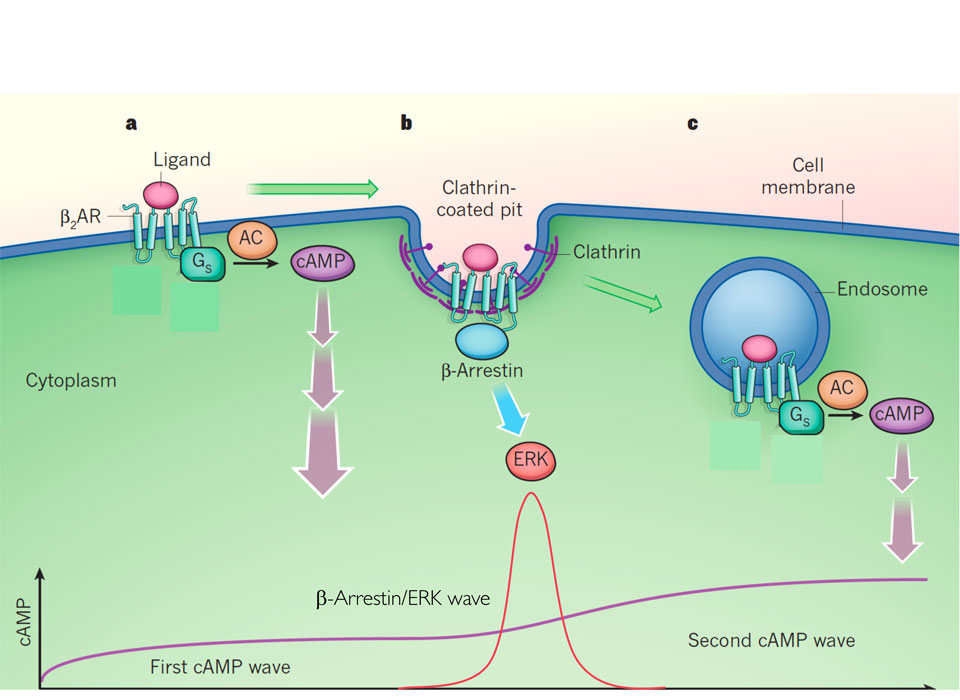
G-Protein-gekoppelte Rezeptoren - ihre Aktivierung, ihre Signale und ihre zelluläre Lokalisation
Adaptiert von Lohse&Calebiro, Nature 495, 457-458
Überblick
Unsere Gruppe befasst sich mit den Mechanismen der Aktivierung und Signalübertragung von G-Protein-gekoppelten Rezeptoren (GPCR) und den nachfolgenden Schritten und Signalkaskaden, die zu Veränderungen von Zellfunktionen führen.
G-Protein-gekoppelte Rezeptoren (GPCRs) sind eine große Familie mit etwa 800 Mitgliedern, zu der Rezeptoren für Licht, Geschmack und Geruch, aber auch viele Rezeptoren für Transmitter und Hormone gehören. Sie sind auch die wichtigste Gruppe von Zielstrukturen für Arzneimittel, z. B. Betablocker, Antihistaminika und Opiate.
Alle GPCRs haben gemeinsame strukturelle Merkmale, vermutlich auch gemeinsame Aktivierungsmechanismen, und sie alle signalisieren über heterotrimere G-Proteine (Gαβγ) und - zu einem späteren Zeitpunkt der Aktivierung - über β-Arrestine. Wir verwenden eine Vielzahl von biochemischen und pharmakologischen Methoden sowie neue mikroskopische Techniken, um die Mechanismen ihrer Funktion und ihr Potenzial als Ziele für innovative Arzneimitteltherapien zu untersuchen.
Wir arbeiten eng mit der AG Receptor Signalling am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), in dem große Teile unserer Gruppe tätig sind. Manche Themen und Methoden sind vorzugsweise dort, andere bei ISAR Bioscience in Planegg etabliert.
Themen
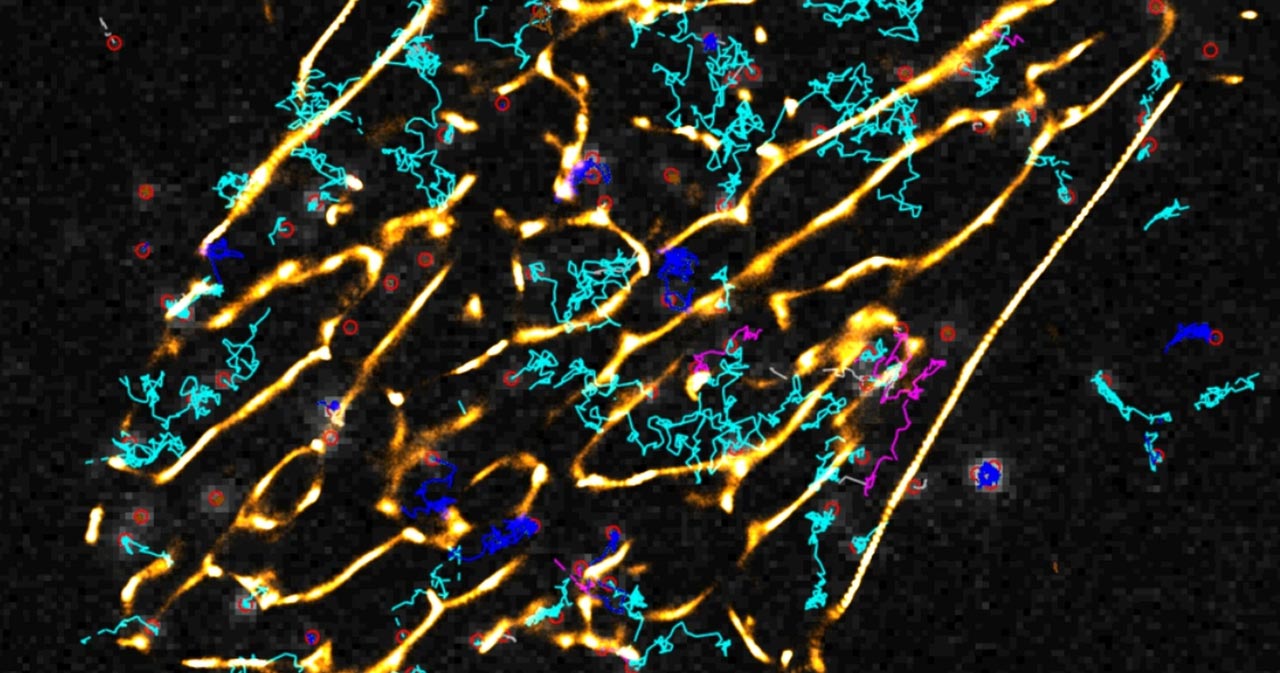
Wo, wann und wie schnell werden Rezeptoren aktiviert?
Die Aktivierung von GPCRs wird durch die Bindung eines Liganden (z. B. Adrenalin, Glutamat) an eine bestimmte Stelle eines Rezeptors ausgelöst. Daraufhin kommt es zu einer Konformationsänderung des Rezeptors, die es ihm ermöglicht, an G-Proteine zu binden und diese zu aktivieren. Wir haben Methoden entwickelt, um diese Signalereignisse mit Hilfe der Fluoreszenzmikroskopie zu verfolgen, und wir wollen untersuchen, wo und wann in einer Zelle diese Signale auftreten. Wir verwenden Techniken zur Auslösung der Rezeptoraktivierung durch Licht, um die Signalübertragung mit einer Auflösung im Submillisekundenbereich zu überwachen. Wir arbeiten auch an Techniken zur Anpassung solcher Messungen an das Hochdurchsatz-Screening, um nach Verbindungen mit ungewöhnlichen Signaleigenschaften zu suchen, die sie zu einer neuen Klasse von Arzneimitteln machen könnten, die im Vergleich zu herkömmlichen Arzneimitteln nur eine Untergruppe von Wirkungen aufweisen.
Kommt cAMP in Nanodomänen vor?
Zyklisches Adenosinmonophosphat (cAMP) ist ein der GPCR-Aktivierung nachgeschalteter Botenstoff, der bei vielen physiologischen Prozessen eine wichtige Rolle spielt, von der Regulierung des Herzschlags und seiner Kraft bis zur synaptischen Plastizität. Obwohl cAMP eine frei diffundierbare Substanz zu sein scheint, deuten neuere Erkenntnisse darauf hin, dass es in Zellen in hohem Maße lokalisiert wirken kann. Wir versuchen, solche lokalen Effekte sichtbar zu machen, und suchen nach Mechanismen, die zu den postulierten Nanokompartimenten führen könnten. Dazu verwenden wir Modelle, die von der Entwicklung und Expression spezifischer cAMP-Sensorproteine bis zu Studien in transgenen Fliegen- und Mausmodellen reichen, in denen wir versuchen, lokale cAMP-Signale abzubilden.
Wie und warum bilden Rezeptoren Oligomere?
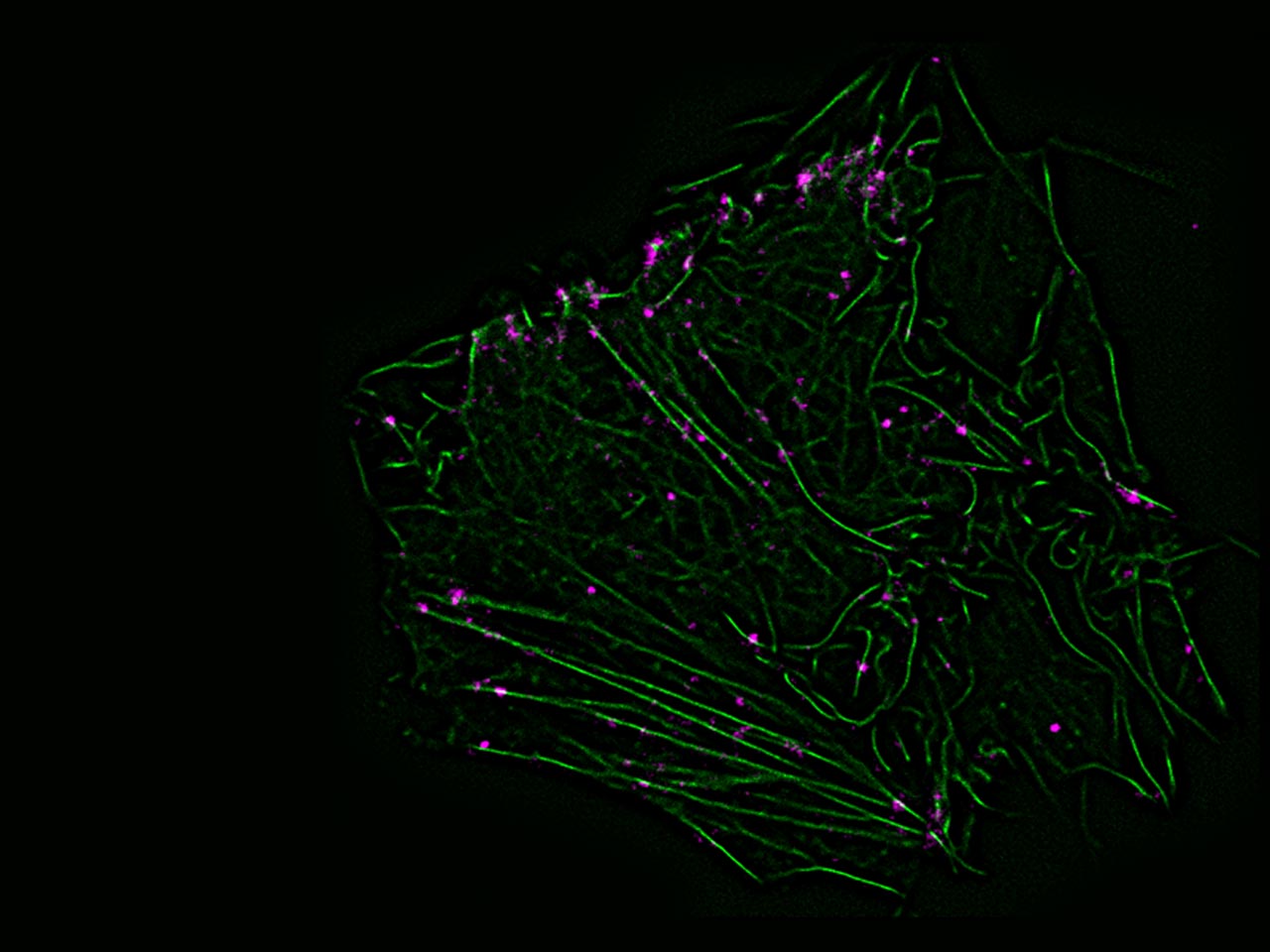
GPCRs können supramolekulare Komplexe (d. h. Di-/Oligomere) auf der Zelloberfläche bilden. Ihre Größe, Natur und Dynamik sowie ihre physiologischen und pharmakologischen Auswirkungen sind jedoch noch weitgehend unbekannt. Wir konzentrieren uns auf die Untersuchung der Dimerisierung von Rezeptoren (insbesondere von adrenergen, Opiat- und Chemokinrezeptoren) auf der Oberfläche intakter Zellen sowie auf die Bewertung der Rolle der Dimerisierung bei der Rezeptoraktivierung und der nachgeschalteten Signalgebung. Dazu verwenden wir verschiedene biochemische und mikroskopische Techniken, insbesondere die Helligkeitsanalyse und die Einzelpartikelmikroskopie.
Methoden
Epifluoreszenz, konfokal, höchstauflösend
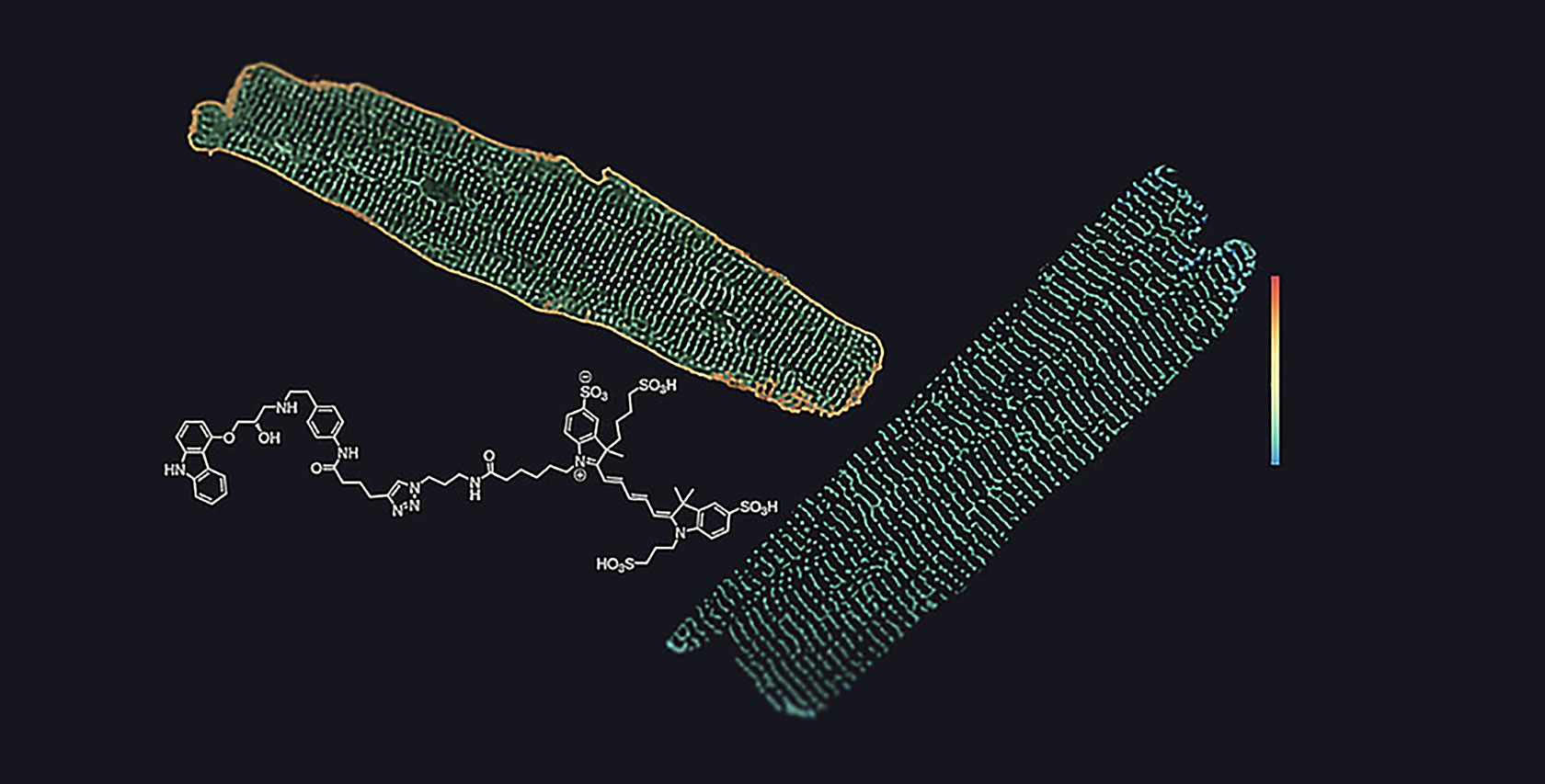
Zum Aufspüren von Rezeptoren oder Effektorproteinen verwenden wir fluoreszierende Markierungen unterschiedlicher Art: fluoreszierende Proteine, Antikörper, nichtorganische Chemikalien usw. In unserem Labor steht eine breite Palette von Mikroskopen zur Verfügung, darunter konfokale Mikroskope, Fluoreszenzmikroskope mit interner Totalreflexion und maßgeschneiderte Mikroskope für die Photolyse. Die Mikroskope sind mit Photodetektoren und Kameras der neuesten Generation ausgestattet, die eine hohe zeitliche und räumliche Auflösung der Messungen ermöglichen.To track receptors or effector proteins we use fluorescent labels of different nature: fluorescent proteins, antibodies, non-organic chemicals, etc. A broad range of microscope designs is available in our lab, including confocal microscope, total internal reflection fluorescence microscope, custom-built microscope for photolysis. Microscopes are equipped with the newest generation of photodetectors and cameras, providing high temporal and spatial resolution of measurements.
Energietransfer durch nichtradiative Dipol-Dipol-Kopplung
Wichtige biophysikalische Instrumente, die in unserem Labor eingesetzt werden, sind der Förster-Resonanz-Energie-Transfer (FRET) und der Biolumineszenz-Resonanz-Energie-Transfer (BRET). Sie ermöglichen die Messung von Abständen zwischen Domänen und Motiven innerhalb oder zwischen Proteinen und liefern Informationen über Rezeptorkonformationen, die Aktivierung von G-Proteinen, die Konzentration von Botenstoffen usw.
Lumineszenz-basiertes Wirkstoff-Screening in Mikrotiterplatten
Mit BRET-basierten Assays, die an Mikrotiterplatten angepasst sind, können wir eine große Anzahl von Verbindungen messen und ihre Auswirkungen auf Rezeptoren und Signalkaskaden bestimmen.
Biochemische Assays zur Untersuchung von Protein- und Nukleinsäurefunktionen
Wir haben zahlreiche biochemische und funktionelle Assays entwickelt, um Proteine und Nukleinsäuren zu charakterisieren, die an Signalprozessen beteiligt sind.
Publikationen
Publikationen AG Lohse in PubMed